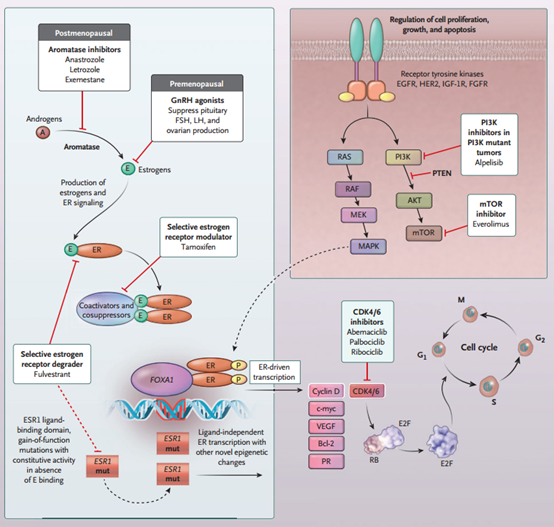
雌激素受体(ER)阳性/人表皮生长因子受体2(HER2)阴性乳腺癌是最常见的乳腺癌亚型,占年龄<50岁患者的65%,占老年患者的75%。雌激素与ER结合后会激活下游的信号通路,最终促进肿瘤细胞生长与增殖。激素治疗为基础的方案可减少ER+乳腺癌患者雌激素的生成、阻断ER信号通路、降解ER或改变ER调控的信号通路或增殖通路(图1)。ZAN帝国网站管理系统
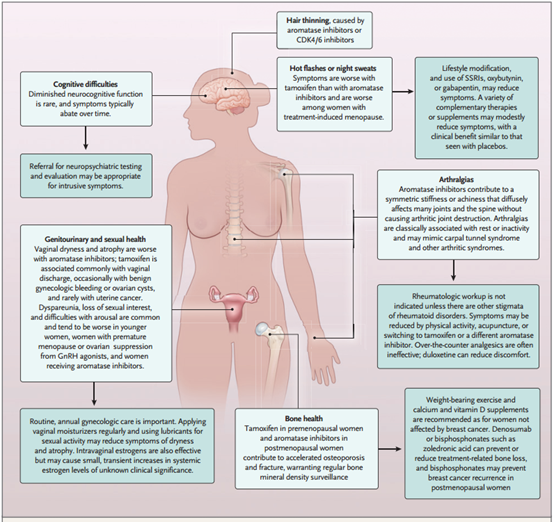
本文简单总结了ER+乳腺癌患者的辅助内分泌治疗、新辅助治疗、转移性患者的内分泌治疗及靶向治疗方案。ZAN帝国网站管理系统
对于几乎所有ER+乳腺癌患者,都建议进行5~10年的辅助内分泌治疗,以预防转移性疾病、局部复发和对侧肿瘤的发生。
Tamoxifen/ target=_blank class=infotextkey>他莫昔芬
不论绝经状态如何,5年Tamoxifen/ target=_blank class=infotextkey>他莫昔芬治疗已是标准治疗方案。当ER表达中等时,可减少10%~30%远处转移和局部区域复发风险;而ER高表达时,可使转移或复发风险减少40%~50%,而且拖尾效应长达15年以上。
ER表达水平是内分泌治疗获益的关键因素。ER和PR阴性患者不能从辅助治疗中获益。
近年来,辅助内分泌治疗的选择越来越多。芳香化酶抑制剂可阻断雄激素转化为雌激素(图1)。将抑制绝经后女性体内90%以上残留的雌激素。但由于代偿性生理反应可诱导卵巢生成雌激素,芳香化酶抑制剂禁止用于未经卵巢抑制的绝经前女性。
与5年他莫昔芬相比,芳香化酶抑制剂更能降低复发风险,因此大多数绝经后女性应考虑将芳香化酶抑制剂治疗作为初始治疗,或在使用他莫西芬2~3年后再使用芳香化酶抑制剂。
他莫昔芬在I期或IIA期患者中的优势稍小,可降低3%的复发风险,10年死亡风险降低2%。因其在小叶癌中具有潜在的预后和治疗价值,芳香化酶抑制剂在高风险肿瘤(根据分期或生物学特征)中更具治疗价值。
与仅5年治疗相比,将他莫昔芬或芳香化酶抑制剂治疗延长至10年可减少复发风险。因淋巴结状态或肿瘤的不良生物特征而增加晚期复发风险的患者可能从延长治疗中获益更多。
前瞻性研究显示,特别在较年轻女性(年龄<40岁)和晚期患者或不良肿瘤生物学特征(luminal B、ER低表达、分期高、Ki67增殖指数高)患者中,当GnRH抑制剂联合他莫昔芬或芳香化酶抑制剂(图1)用于卵巢抑制时,可降低复发风险。
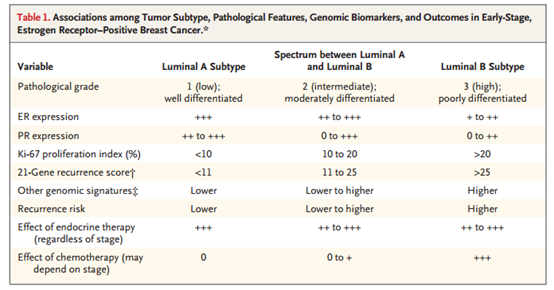
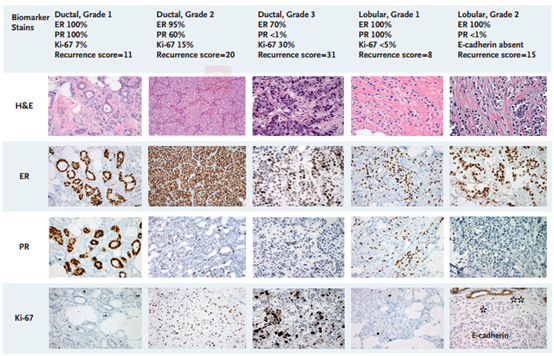
化疗似乎对所有分期和亚型患者都有一定获益。但基因组学的发展引导我们重新定义了辅助化疗的作用(表1,图3)。
表1 早期ER+乳腺癌中肿瘤类型、病理学特征、生物标志物和预后的相关性
前瞻性随机研究显示,化疗加入内分泌治疗并不能使淋巴结阴性、ER+、基因组低风险(21基因复发风险评分≤25)或70基因检测显示低风险的患者获益。同样,化疗也不能降低ER+乳腺癌和有限腋窝淋巴结受累(1~3个+淋巴结)及基因组低风险绝经后乳腺癌的复发风险。
无论淋巴结状态如何,基因组分析对绝经前女性包括40岁以下女性都有预后价值。辅助化疗加入内分泌治疗可使基因组低风险、淋巴结阴性或1~3个腋窝淋巴结阳性的绝经前女性患者有一定程度的风险降低。在这些女性中,与化疗相关的风险降低在很大程度上归因于化疗诱导的绝经,这提示,在很大程度上,风险降低有可能通过抑制卵巢功能实现。
相比之下,对于直径大于1cm、淋巴结阳性或兼具以上两种特征且基因组高风险(21基因复发风险评分>25)患者,辅助化疗(紫杉类、烷化剂、蒽环类)的加入通常是必要的。对于肿瘤直径<1cm且淋巴结阴性或年龄较大(>75岁)的ER+女性患者,一般不加入辅助化疗。
新辅助治疗可改善较大乳腺肿瘤、淋巴结累及或两者兼具患者的手术选择。ER+患者可能对新辅助化疗有应答,但完全的病理缓解并不常见。
既往认为,新辅助内分泌治疗适用于老年女性或不考虑化疗的女性,6个月或以上新辅助内分泌治疗与高应答率相关,并且可使基线时需要乳房切除术的女性进行保乳手术。
选择适合新辅助治疗的患者时,可根据针穿活检后的基因组检测结果。21基因复发风险评分较低的患者对新辅助内分泌治疗的应答较好,而评分较高患者需前期化疗。新辅助内分泌治疗后分期显著降低,同时手术时ER仍为强阳性并且Ki-67水平仍较低的患者具有非常好的远期预后,即便不接受化疗也如此。
转移性ER+乳腺癌常见的复发部位包括骨、骨髓、淋巴结、胸膜、肺、肝和皮肤。中枢神经系统转移较其他乳腺癌亚型少见。以内分泌治疗为基础的方案是转移性ER+患者的初始标准治疗方案,但有明显症状和内脏危象的乳腺癌患者除外,这类患者应接受初始化疗方案。
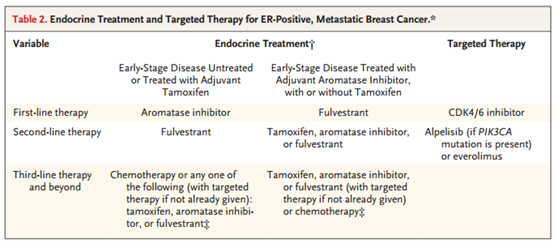
内分泌治疗方案的选择取决于先前的辅助治疗方案(表2)。
大多数患者在不耐受内分泌治疗且需要接受姑息性化疗之前已接受过多种内分泌治疗方案。晚期ER+绝经前女性应接受卵巢抑制,可提高生存率。
芳香化酶抑制剂或他莫昔芬在晚期患者中有效,并且可在既往接受过的患者中重新使用,特别对于既往治疗已停止1年以上的患者。氟维司群可与ER结合,并抑制ER受体介导的信号通路(图1),其在他莫昔芬或芳香化酶抑制剂治疗无效的肿瘤中具有抗肿瘤活性,包括ESR1突变肿瘤。氟维司群+芳香化酶抑制剂可能改善患者尤其是既往未接受内分泌治疗患者的生存时间。
CKD4/6是多种细胞类型细胞周期的重要调控因子(图1)。临床研究显示,CDK4/6抑制剂联合芳香化酶抑制剂(一线治疗)或联合氟维司群(二线治疗)可改善绝经前和绝经后患者的无进展生存期或总生存期,并延迟进行其他细胞毒化疗的起始时间。
约30%~40% ER+患者为PIK3CA突变,Alpelisib是一种PI3K抑制剂,联合氟维司群可改善PIK3CA突变患者的PFS。mTOR抑制剂依维莫司+内分泌治疗可改善经治ER+患者的PFS。在某些惰性、晚期患者中,中断治疗或使用低剂量雌激素或黄体酮后重新引入抗雌激素治疗可能具有临床价值(表2)。
对于内分泌治疗难治性患者,姑息性化疗可带来临床获益,大多数女性患者接受单药化疗的多线治疗或序贯治疗,例如卡培他滨、紫杉烷、其他微管抑制剂、烷化剂、其他抗代谢物或蒽环类药物等。
奥拉帕利和talazoparib与胚系BRCA1/BRCA2/PALB2突变ER+乳腺癌的高ORR相关(>60%)。新型疗法包括第二代SERD、AKT抑制剂等在晚期乳腺癌中均显示出有希望的活性。TROP-2靶向疗法sacituzumab govitecan在经内分泌治疗和化疗的晚期乳腺癌中的ORR为30%。
ER+乳腺癌患者免疫治疗的相关研究正在进行中,与其他亚型相比,ER+患者,尤其是Luminal A型患者的肿瘤负荷更小、肿瘤浸润淋巴细胞水平更低、PD-1/PD-L1表达水平更低、DNA错配修复缺陷突变频率更小,或许更易从免疫治疗中获益。
Systemic Therapy for Estrogen Receptor–Positive, HER2-Negative Breast Cancer. N Engl J Med 2020;383:2557-70.DOI: 10.1056/NEJMra1307118.